
Los macrófagos son células del sistema inmunitario que, además de ser esenciales en la respuesta temprana a infecciones, cumplen un papel fundamental en el funcionamiento adecuado de nuestros tejidos y la regulación de la obesidad. Ahora, investigadores del CIBERFES en el Centro Nacional de Investigaciones Cardiovasculares (CNIC), muestran cómo ocurre esta regulación en un trabajo que se publica en Nature Metabolism, que podría servir para diseñar nuevos tratamientos para la obesidad y el sobrepeso, y para algunas patologías asociadas como el hígado graso o la diabetes tipo 2.
El estudio ha sido liderado por el jefe de grupo del CIBERFES José Antonio Enríquez y el investigador del CNIC David Sancho y ha contado con la colaboración de Juan Pedro Bolaños, jefe de grupo del CIBERFES en la Universidad de Salamanca, así como los centros David Geffen School of Medicine y el Departamento de Medicina/División de Cardiología, ambos de la Universidad de California-Los Ángeles (UCLA), en EEUU, la Universidad de Eastern Finland y la Kuopio University Hospital (Finlandia) y la Universidad Complutense de Madrid. El trabajo explica cómo la activación del metabolismo mitocondrial de los macrófagos que se produce en respuesta al estrés oxidativo generado por exceso de nutrientes contribuye a la inflamación del tejido adiposo y a la obesidad.
“En las últimas décadas, diversos estudios han comprobado que, en condiciones normales, los macrófagos del tejido adiposo facilitan un ambiente antiinflamatorio y reparador, contribuyendo a desactivar cualquier proceso que altere la función normal de este tejido; estos macrófagos se conocen como antiinflamatorios o ‘tipo M2’”, explica el Dr. Enríquez. Sin embargo, en ciertas situaciones, añade, “los macrófagos M2 interpretan las señales de estrés, que normalmente aparecerían en respuesta a una infección, y promueven inflamación como mecanismo defensivo”.
Dichos procesos inflamatorios originados por los macrófagos, afirma el Dr. Enríquez, son responsables de la aparición de alteraciones que afectan al tejido adiposo y “están en el origen de la obesidad y del síndrome metabólico asociado a trastornos cardiovasculares, hígado graso o diabetes tipo 2”. Así, como respuesta al exceso de nutrientes generados por una dieta elevada en grasas, “los macrófagos cambian su función y favorecen procesos inflamatorios, formando macrófagos proinflamatorios de ‘tipo M1’”.
La investigación que ahora se publica ha analizado cómo los cambios metabólicos en los macrófagos regulan este proceso inflamatorio que subyace a la obesidad y el síndrome metabólico. Los nuevos hallazgos, señala Rebeca Acín-Pérez, actualmente en la UCLA, “revelan cómo la detección de señales de peligro oxidativo, conocido como especies reactivas de oxígeno, por parte de los macrófagos, induce cambios en el metabolismo mitocondrial de dichas células inmunitarias que son necesarios para su diferenciación a un tipo proinflamatorio M1. Este estrés oxidativo –aclara-, está presente en los pacientes con obesidad mórbida y parece estar relacionado con la dieta rica en grasas, frecuente en la inadecuada dieta occidental”.
Una de las concusiones de este estudio, asegura el Dr. Sancho, es que demuestra que, si se reduce dicho estrés oxidativo, “se atenúan algunos de los parámetros perjudiciales asociados a la obesidad”.
En estudios previos, los científicos del CNIC y el CIBERFES habían encontrado que la proteína Fgr es clave para regular la actividad de uno de los complejos de la cadena de transporte de electrones mitocondrial, el complejo II, en respuesta a este estrés oxidativo, y favorecer la generación de señales (citoquinas y metabolitos) que promueven la respuesta inmunitaria.
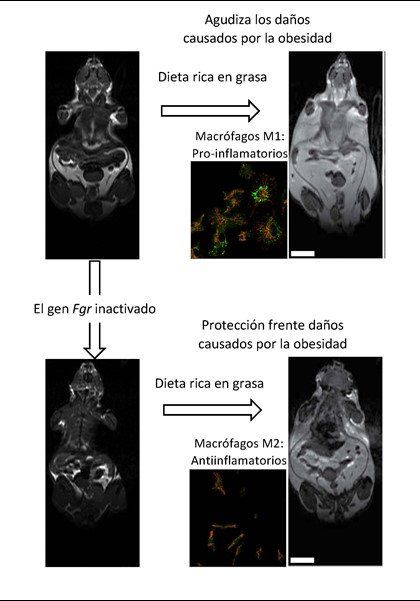
En este trabajo, señala Salvador Iborra, “hemos demostrado que este mismo mecanismo molecular regula el proceso de conversión de un macrófago antiinflamatorio (M2) que regula la función del tejido a un macrófago de tipo proinflamatorio (M1), en el que se acumulan gotas lipídicas (Fig. 1). Un equilibrio entre ambos tipos de macrófagos M2/M1 es crucial para un correcto funcionamiento del organismo”.
Aunque la inflamación es una respuesta normal del organismo y beneficiosa para enfrentarse a agresiones cuando es aguda y transitoria, es muy perjudicial cuando se vuelve persistente o crónica, aun siendo de bajo grado. Esto, explican los investigadores, ocurre en la obesidad y el síndrome metabólico y conduce a una mayor mortalidad cardiovascular o la aparición de diabetes.
La información que aporta este nuevo trabajo demuestra que, en ausencia de la proteína Fgr, el hígado incrementa su capacidad para eliminar grasas, generando cuerpos cetónicos (compuestos químicos producidos por la cetogénesis, un proceso por el cual las grasas del cuerpo son utilizadas como fuente de energía) que se eliminan a través de la orina, y mejorando también las alteraciones que la obesidad causa en el metabolismo de la glucosa (diabetes tipo 2).
 |
Los resultados, obtenidos en ratones, han sido corroborados en cohortes humanas donde los autores han encontrado una fuerte correlación entre la expresión de Fgr y los efectos negativos derivados de obesidad. Los investigadores concluyen que sus datos sugieren la posibilidad de emplear inhibidores específicos de la proteína Fgr como tratamiento para los pacientes obesos y/o con síndrome metabólico, con el objetivo de reducir la inflamación asociada y mejorar así los parámetros asociados con estas patologías, como el hígado graso o la diabetes tipo 2, contribuyendo así a aumentar su esperanza y calidad de vida. La obesidad es uno de los principales problemas de salud ya que está implicada en el desarrollo de enfermedades cardíacas, accidentes cerebrovasculares, cáncer, hígado esteatosis, síndromes metabólicos, hipertensión arterial y algunas enfermedades autoinmunes. Una combinación de ingesta excesiva de nutrientes, falta de actividad física y los factores genéticos de riesgo conduce a un desequilibrio en la demanda de energía frente a la energía consumida que inicia la obesidad. Solo en España se estima que, en poco más de una década, para 2030, habrá 27 millones de adultos, el 80% hombres y 55% mujeres, con problemas de obesidad o sobrepeso. |
| Imágenes de resonancia magnética de ratones donde se aprecia (en color más claro) el aumento en grasa corporal cuando se administra una dieta rica en grasa. Estos cambios son interpretados por los macrófagos como una señal de peligro, diferenciándose a macrófagos M1, que se caracterizan por la acumulación de gotas de grasa (en verde). Los M1 aumentan la inflamación y los daños asociados a la obesidad. Cuando se inactiva el gen Fgr los macrófagos se vuelven menos sensibles a las señales de estrés, manteniendo un papel antiinflamatorio (M2) protector, disminuyendo la acumulación de grasa corporal. |
Artículo de referencia
Acin-Perez, R., Iborra, S., Martin-Mateos, Y., Cook, E. C. L., Conde-Garrosa, R., Petcherski, A., . . . Enriquez, J. A. (2020). Fgr kinase is required for proinflammatory macrophage activation during diet-induced obesity. Nature Metabolism. https://doi.org/10.1038/s42255-020-00273-8
El estudio ha contado con la financiación de The International Human Frontier Science Program Organization (HFSP RGP0016/2018).